生物物理所等揭示環二核苷酸和葉酸的跨膜轉運機制
軍工資源網 2022年10月24日環二核苷酸(cyclic dinucleotides,CDNs)是自然界中重要的信使分子。哺乳動物細胞生成一種特異的CDN:2'3'-cGAMP,其由天然免疫受體cGAS在感知細胞質異常DNA信號后催化產生。2'3'-cGAMP結合并激活下游的接頭蛋白STING,進而誘發廣譜的免疫反應。除了2'3'-cGAMP,病原菌分泌的多種CDN以及廣受關注的CDN類抗癌藥物,均可激活STING并調節免疫反應。
該領域持續關注的問題之一是極性的CDN分子如何跨膜進入細胞?有研究表明,溶質載體家族蛋白SLC19A1是關鍵的CDN轉運蛋白。除了CDN,SLC19A1是主要的葉酸和抗葉酸轉運蛋白。部分抗葉酸藥物通過某種“神奇且未知的機制”被經常用于治療一些自身免疫類疾病。SLC19A1由于可同時轉運這兩類底物,且對這兩類底物的轉運存在相互抑制,從而被推測可能在此過程中發揮作用。
鑒于SLC19A1在CDN、葉酸及抗葉酸跨膜轉運中的重要功能,關于其底物識別機制的研究將有助于SLC19A1相關疾病的機理分析和潛在藥物的開發與優化。10月20日,中國科學院生物物理研究所研究員高璞團隊/張立國團隊以及北京理工大學教授高昂團隊合作,在《自然》(Nature)上,在線發表了題為Recognition of cyclic dinucleotides and folates by human SLC19A1的研究論文,揭開了SLC19A1識別不同底物分子的神秘面紗。
該研究進行大量篩選,獲得了一系列識別SLC19A1的鼠源單抗來穩定蛋白樣品。利用其中一種剛性結合抗體,研究解析了SLC19A1向細胞內側開口(inward-open)的無底物狀態電鏡結構。SLC19A1是由12根跨膜螺旋組成的MFS類型轉運蛋白,這一結構鑒定了SLC19A1 inward-open構象下的關鍵元件及分子內互作。SLC19A1底物通道內腔及胞質側入口攜帶大量的正電荷,與SLC19A1所轉運底物的陰離子特性相契合。研究通過對已報道的功能缺失或疾病相關突變進行mapping,發現這些突變多會影響底物識別、轉運或蛋白自身折疊。
進一步,科研人員解析了SLC19A1與不同來源的三種CDN復合物inward-open狀態的電鏡結構。三種CDN分子均是通過形成緊密且精巧的二聚體單元結合于SLC19A1的正電荷內腔底部,而這種底物識別方式在其他SLC或MFS家族蛋白中尚未被報道。CDN二聚體單元呈現堿基在中間、磷酸糖環在兩端的構象,這種特殊的組裝方式依賴兩個CDN分子間的堆疊和氫鍵互作。雖然不同CDN的結合模式大致類似,但它們各自的二聚體單元卻存在明顯的構象差異,這反應了SLC19A1對不同CDN具有廣泛的包容性。
為探索SLC19A1識別葉酸和抗葉酸的機制,研究人員利用一組新的抗體解析了SLC19A1與5-MTHF(飲食和血液中主要存在的還原型葉酸)和PMX(一類新型抗葉酸藥物)復合物的高分辨率電鏡結構。然而,與CDN不同,5-MTHF和PMX均以單體形式結合在SLC19A1極性腔的中上部。此前已知SLC19A1對還原型葉酸的轉運效率遠高于普通葉酸,研究發現這是由于SLC19A1與5-MTHF的5位甲基和8位氫原子形成了額外的相互作用。
雖然CDN和葉酸/抗葉酸與SLC19A1的結合位點完全不同,但兩種底物都經由相同的內部通道進行轉運,因此二者之間顯然存在競爭性抑制。該研究對兩個底物結合口袋進行系統性突變分析發現,有些突變會同時影響兩類底物的轉運,而有些突變則僅對某一類底物的轉運產生顯著影響,這提示后續或設計出具備底物抑制選擇性的小分子藥物。
該研究報道了人源SLC19A1識別CDN、葉酸及抗葉酸等不同底物的分子基礎,揭示了其獨特且多樣的底物識別機制,并鑒定了SLC和MFS家族的全新底物識別模式。該成果為開發新一代CDN類藥物和抗葉酸類藥物提供了新思路。同時,該研究中建立的抗體篩選平臺與已獲得的多種單抗為抗體類藥物的開發提供了基礎。研究工作得到國家自然科學基金委員會、科技部、北京市自然科學基金委員會、中科院等的支持。相關實驗得到生物物理所蛋白質科學研究平臺的支撐。
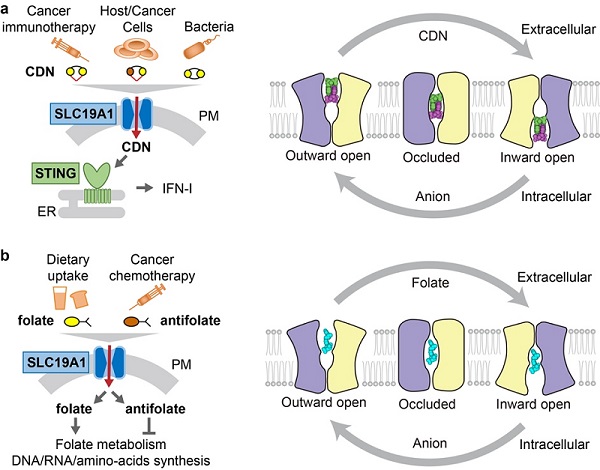
SLC19A1轉運CDN(a)和葉酸/抗葉酸(b)概念圖及模式圖
